Контактирование с микроорганизмами окружающей среды в первые дни жизни способствует колонизации желудочно-кишечного тракта (ЖКТ) бактериями и установлению баланса его микробиоты. Это позволяет развиться как лимфоидным тканям слизистых оболочек, способных организовать активный иммунный ответ против вредных микробов, так и толерантности к безвредным антигенам, например, комменсальным бактериям.
Хорошие показатели легко достигаются на начальном этапе производства, когда нагрузка на защитный барьер ЖКТ вследствие влияния внешней среды еще невысока и больше энергии идет в рост. Этого эффекта удавалось достичь сравнительно малыми средствами, используя пищевые антибиотики, которые к тому же предотвращали передачу патогенов дальше по пищевой цепочке. Влияние антибиотиков на микробиоту ЖКТ зависит от спектра их действия, дозировки, метода введения в организм животных, фармакокинетических и фармакодинамических качеств. Таким образом, подавляя различные бактерии антибиотиками, можно добиться ускорения роста поросят.
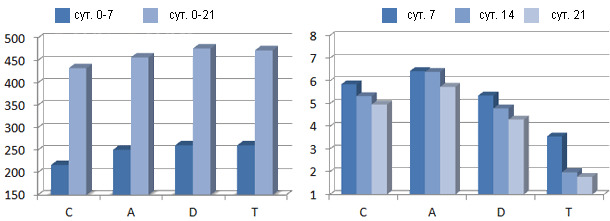
Из графиков 1 и 2 видно как разные виды антибиотиков улучшали потребление корма здоровыми поросятами на доращивании, оказывая в то же время различное воздействие на микробиоту кишечника (C=контроль, А=амоксициллин, D=доксициклин, Т=тилмикозин). Исследования на микроуровне показали, что количество разновидностей бактерий снизилось независимо от типа примененного антибиотика.

 |
|
| График 1. Потребление корма, г/сут. | График 2. Число энтеробактерий, log10 КОЕ/г. |
Trevisi и др., 2011
Текущие цели ЕС по производству более безопасных продуктов животного происхождения включают заметное сокращение риска содержания в них энтеропатогенов и антибиотиков. Кроме того, сокращение использования антибиотиков в животноводстве считается необходимым для противодействия распространению эффекта возрастающей резистентности патогенов антибиотикам, применяющимся для лечения людей. Это стимулирует поиск альтернатив, помогающих на практике снизить использование кормовых антибиотиков в свиноводстве.
Технологии кормления, выбор сырья для производства кормов и включение в рацион добавок – все это может привести к такой перестройке микробиоты ЖКТ, которая снизит расход энергии на поддержание жизни животных и позволит держать патогенные бактерии под контролем. Ниже приведен обзор некоторых практических способов достижения этих целей:
1- Подбор рациона. Качество полисахаридов в рационе влияет на изменения в микробиоте, но они должны быть увязаны с потреблением протеина, чтобы минимизировать элиминацию метаболитов белкового распада. Избыток некоторых питательных веществ и микроэлементов (сахар, железо и т.д.) может излишне стимулировать патогенные бактерии, поэтому лучшим выходом будет обеспечить поступление достаточного количества высокоусваиваемых углеводов и только некоторых (но ценных) протеинов.
2- Прямое воздействие на функционирование микробиоты ЖКТ: органические кислоты, обычно комбинированные и частично защищенные – надежное средство. С другой стороны, эфирные масла требуют применения их в больших дозах и слишком быстро впитываются пищеварительным трактом. Плазма крови, в свою очередь, – интересная, но дорогостоящая альтернатива.
3- Стимулирование защитного барьера ЖКТ. Организм матери – основной фактор, формирующий микробиоту ЖКТ новорожденных поросят. Попытки воздействия на микробиоту свиноматок через диету (включая использование пробиотиков) с целью модифицировать микробиоты приплода и тем самым улучшить сохранность поросят на ранних периодах жизни и показатели при отъеме имели частичный успех. Тем не менее, этот метод не получил широкого распространения.
При отъеме поступление микроорганизмов с кормом может помочь сохранить бактериальный баланс или изменить его в пользу лучших комменсальных бактерий, колонии которых переживают временное истощение в связи с послеотъемным стрессом. Для этого нужны такие пробиотики, как, например, некоторые штаммы Lactobacillus amylovorus.
Отдельные пробиотики изучались, в силу их свойств (выработка бактерицидных молекул, стимулирование иммунного ответа, конкурирование за места адгезии и т.д.), на предмет использования для противостояния некоторым энтеропатогенам. В общем случае, данные показывают, что пероральное введение может быть предпочтительным или, как минимум, безвредным способом. Тем не менее, известны случаи, когда дача пробиотиков борющимся с болезнью свиньям ухудшала состояние этих животных. Такая разница в результатах могла возникнуть вследствие использования разных исследовательских моделей, либо из-за несовпадения начальных микробиологических условий.
Достоверных данных о специфических иммунных ответах, индуцированных комменсальными бактериями, или о взаимном влиянии друг на друга «диких» бактерий и введенными перорально пробиотиками, накоплено не много. Стало быть, пробиотики не всегда эффективны. Критерий толерантности имеет значение для здоровых животных и влечет за собой определенный риск, если они подверглись заражению. Включение в корм поросят других пробиотиков, например, дрожжей и некоторых их производных также выглядит многообещающим.
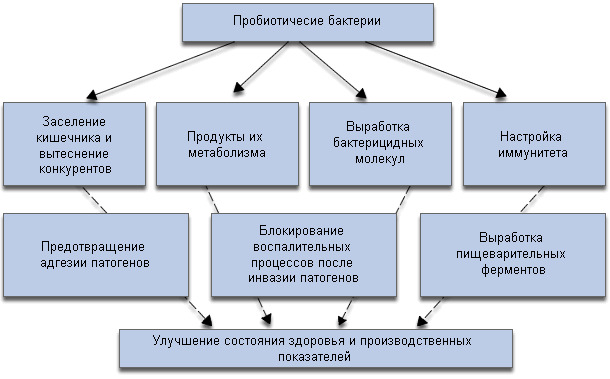
Диаграмма 3- Механизмы положительного влияния пробиотиков на рост и состояние здоровья животных.
4- Использование аминокислот. Добавлением триптофана и треонина можно компенсировать перерасходованную из-за воспалительных процессов и выработки слизи и иммуноглобулинов энергию, особенно у свиней, предрасположенных к колибактериозу. В наши дни существуют новые молекулярные тесты для выявления такой индивидуальной предрасположенности, которые они могут помочь не только в выбраковке свиней, но и в улучшении технологий их питания.
5- Оксид цинка. Используемый в фармацевтических дозах, значительно изменяет микробиоту и может ускорить рост, однако, экологически неустойчив.


