Клинические признаки инфекции вируса респираторно - репродуктивного синдрома свиней (РРСС) могут быть разнообразными, и поэтому клинический диагноз должен быть подтверждён лабораторными исследованиями. Чаще всего твёрдофазный иммуноферментный анализ (ТИФА) и ОТ - ПЦР используются для обнаружения антител, специфичных к вирусу РРСС или вирусной нуклеиновой кислоты, соответственно.
Выбор подходящего диагностического подхода зависит от цели диагностики. Высокоспецифичные методы предпочтительны для мониторинга отрицательных на вирус стад, в то время как тестирование спермы отдельных хряков потребует максимальной точности и методов выявления инфекции на максимально возможном раннем этапе. При планировании и исполнении программы контроля РРСС самый лучший подход заключается в использовании комбинации методов ТИФА и ПЦР с последующим анализом последовательности ДНК. Протокол отбора проб на каждой данной ферме должен быть спланирован индивидуально, в зависимости от цели диагностики и организации хозяйства. На простейший вопрос, является ли ферма инфицированной вирусом РРСС, можно ответить посредством тестирования 10 - 20 свинарников - откормочников методом ТИФА. Детальный анализ циркуляции вируса РРСС на ферме полного цикла, или в многолокационной производственной системе требует тестирования большого количества образцов, представляющих несколько возрастных групп и всех локаций свиноводческой системы, так как они могут представлять независимые вирусные экосистемы.

Интерпретация сероконверсии или обнаружения вирусов на фермах, где используются модифицированные живые вакцины, является сложной задачей, так как (1) на рынке нет маркерных вакцин, (2) вакцинные вирусы могут сохраняться на вакцинированных фермах, и (3), по крайней мере, в течение некоторого времени они могут сосуществовать со штаммами дикого типа. На таких фермах требуется анализ последовательности ДНК ампликонов, полученных в разных возрастных группах на ферме, для полного понимания циркуляции вируса РРСС.
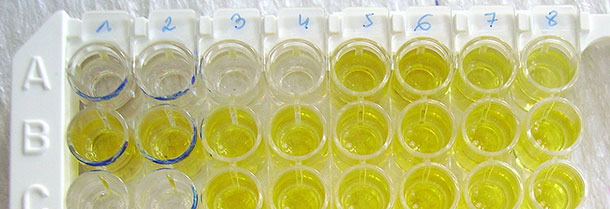
Серологическую диагностику, основанную на ТИФА, легко выполнить, и она имеет в целом хорошую специфичность и точность при обследовании всего стада. Однако, сыворотка отдельных, особенно взрослых свиней иногда ошибочно даёт положительную реакцию. Это представляет собой проблему мониторинга незаражённого поголовья и требует повторного тестирования образцов другим методом (например, ИПМА, НРФА или при использовании другого теста ТИФА более высокой специфичности), или посредством взятия новых образцов у свиней через 2 - 3 недели. Этот аспект использования ТИФА редко рассматривается при оценке диагностических компетенций. Низкая точность используемого комплекта ТИФА может быть преодолена путём увеличения числа протестированных образцов. Низкая специфичность всегда требует применения дополнительных инструментов.
Обычно любой комплект ТИФА используется для определения антител против любого генотипа вируса РРСС, но комплекты, использующие антигены только из одного генотипа вируса РРСС часто менее чувствительны ко второму генотипу. Существуют также наборы, отличающие сероконверсию в отношении двух генотипов, но из-за серологической перекрёстной реакции между двумя генотипами результаты должны быть интерпретированы с осторожностью. Всегда рекомендуется проведение селективной ПРЦ амплификации, чтобы подтвердить на ферме диагноз коинфекции двумя генотипами.
Методы ПЦР обнаруживают вирусные нуклеиновые кислоты путём комплементарного связывания коротких синтетических олигонуклеотидов (праймеров) с конкретными фрагментами генома вируса, который затем амплифицируется в ферментативной реакции. В наиболее широко используемых методах ПЦР в режиме реального времени продукт реакции обнаруживается регистрацией сигнала, излучаемого пробой ДНК после связывания специфичной последовательности. По причине природы этой реакции такой сигнал может испускаться при отсутствии вирусной последовательности, особенно в поздних циклах ПЦР, которые могут напоминать слабый положительный результат.


Эллингсон 2013, Диссертация, Государственный университет Айовы
Однако, основная проблема в отношении методов ОТ - ПЦР связана с высоким генетическим разнообразием вируса, что может приводить к накоплению нуклеотидных мутаций во фрагментах генома, где связываются праймеры и пробы, и, следовательно, к ложным отрицательным результатам ПЦР. Результаты сравнительного анализа коммерческих комплектов для ОТ - ПЦР, представляемых Справочной лабораторией МЭБ (Подгорска и др., 2015), показали, что некоторым коммерческим комплектам для ОТ - ПЦР не удалось обнаружить штаммы вируса РРСС типа 1, происходящих в основном из Восточной Европы. По причине ограниченной доступности последовательностей из Восточной Европы, большинство праймеров и проб в методах, используемых в настоящее время, были разработаны на основе классических штаммов типа 2 и 1 подтипа 1, в то время как восточноевропейские штаммы подтипов 2 - 4 генетически сильно отличаются (Стадежек и др., 2013). Более того, было доказано, что некоторые из них являются более вирулентными по сравнению со штаммами, циркулирующими в Западной и Центральной Европе, поэтому больше внимания следует уделять обнаружению штаммов на ранних этапах в случае их распространения.
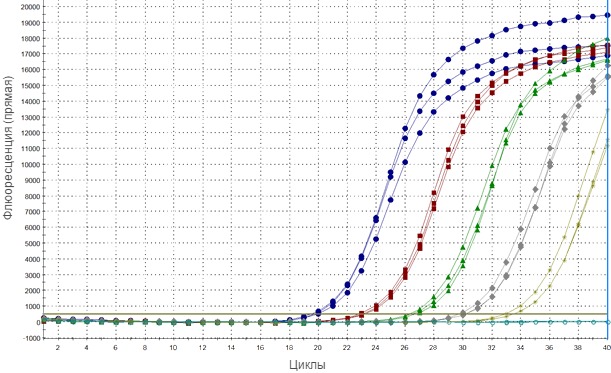
В настоящее время ни один анализ ОТ - ПЦР не может быть рекомендован в качестве универсального метода, позволяющего обнаружить все штаммы вируса РРСС с оптимальной точностью. Эти наблюдения подчёркивают необходимость тщательной оценки используемых в настоящее время методов и их постоянную перепроверку, продиктованную циркулирующими в настоящее время штаммами. Для этого необходимо создать коллекцию репрезентативных штаммов вируса РРСС, охватывающих известное генетическое разнообразие вируса, что на данный момент является одной из самых важных целей для справочных лабораторий в отношении РРСС.





