Клинические проявления
Большинство инфекций, вызванных M. Hyopneumoniae, являются субклиническими. В случае же, если болезнь протекает в клинической форме, самым очевидным симптомом является сухой непродуктивный кашель. В экспериментах с инфицированием поголовья, кашель появляется на 10-14 день после заражения, достигает максимума к 4-5 неделе, после чего постепенно угасает. В условиях реального производства, кашель можно наблюдать в секциях доращивания, начальной и конечной стадий откорма, и обычно он присутствует у значительной части поголовья. В случае множественных инфекций с участием других респираторных патогенов, клинические симптомы и поражения легких имеют гораздо более острый характер. Инфицирование M. Hyopneumoniae ведет к увеличению конверсии корма, снижению среднесуточных привесов и большему разбросу значений массы свиней.

M. Hyopneumoniae – это патоген из числа тех, что в комплексе респираторных болезней свиней (КРБС) играют ключевую роль. КРБС подразумевает действие как бактериальных (потенциально связанных с энзоотической пневмонией), так и вирусных (вирус РРСС, ЦВС-2, вирус болезни Ауески, вирусы свиного гриппа и респираторный коронавирус свиней) агентов. С клинической точки зрения, для КРБС характерны замедление роста, снижение эффективности корма, анорексия, лихорадка, кашель, а также наличие одышки у свиней на откорме.
Диагностика
Предварительный диагноз на микоплазменную пневмонию основан на наличии клинической симптоматики (хронический сухой непродуктивный кашель, сопровождающийся низкими производственными показателями), типичных макроскопических уплотнений в краниовентральных частях легкого (на фото) и обнаруженного гистопатологическими методами присутствия характерных перибронхиолярных и периваскулярных уплотнений и узелков. В то же время, ни клинические симптомы, ни патология легких для M. Hyopneumoniae не являются патогномоническими. Кроме того, зачастую речь идет о смешанных инфекциях, симптомы которых не столь типичны для M. Hyopneumoniae.
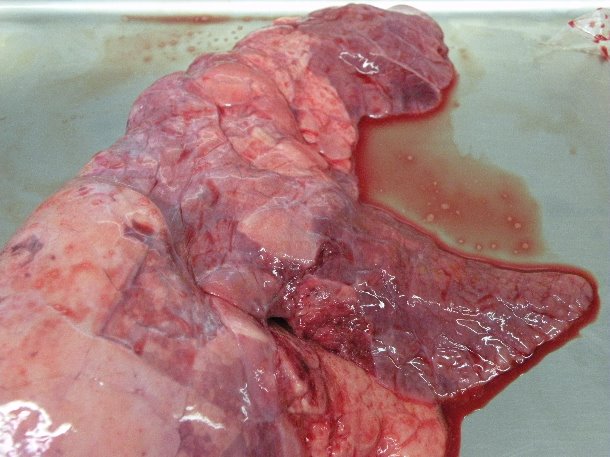
Катаральная пневмония в краниовентральных частях легкого, в результате экспериментального заражения M. hyopneumoniae.
Количественно, как клинические симптомы, так и патологические изменения, описываются с использованием скоринговых систем. Было замечено, что индекс кашля, зависящий от количества животных с кашлем в заданный промежуток времени, в реальных условиях соответствует профилю инфекции M. Hyopneumoniae (Maes и др., 1999; Nathues et al. 2012). Оценку патологий легких можно проводить на павших или специально для этого умерщвленных животных. Можно, однако, это делать и во время регулярных проверок, проводимых на забое. Для получения достоверной оценки превалентности и тяжести патологических изменений следует обследовать легкие не менее чем тридцати (а лучше - больше) животных (Davies и др., 1995). Проведение обследований во время забоя может помочь обнаружить субклинические респираторные инфекции, которые также могут неблаготворно влиять на производственные показатели. Большинство скоринговых методов основано на визуальной субъективной оценке величины поверхности/объема пораженной части легкого, что подразумевает возможность ошибок. Наличие тяжелого плеврита может замаскировать симптомы пневмонии, а результат его лечения, проводимого во время откорма, может оказаться, якобы, неудачным. Так что, субъективность скоринговых методов, обратимость легочных симптомов и их неспецифичность исключают этиологическую диагностику, построенную на одном только обследовании макропатологий легких, проводимом во время забоя.
Выделение M. Hyopneumoniae, которое до сих пор считается «золотым» стандартом диагностики, на практике почти не используется в силу сложности, дороговизны и затрат времени на проведение. Заключительный диагноз ставится, в основном, если ПЦР-анализ показал наличие патогенов (их частей), либо если при ИФА-диагностике были обнаружены антигены, либо по результатам серологических исследований. В настоящее время существует множество ПЦР-методик, а M. Hyopneumoniae может быть детектирована как в образцах, взятых из носа или трахеи, так и в бронхоальвеолярной жидкости (БАЖ) или легочной ткани мертвых животных. На практике, мазки из носа живых животных взять нетрудно, но чувствительность метода гораздо ниже, чем при исследовании проб из трахеи или БАЖ. Vranckx и др.,(2012) проводилась оценка инфекционной нагрузки свиней различных возрастных групп, содержавшихся на четырех различных фермах, с помощью кПЦР-анализа БАЖ (Рис.1). Самые высокие показатели получены в самых старших возрастных группах. Этот же коллектив авторов также вскрыл существование положительной корреляции между количеством микроорганизмов M.Hyopneumoniae, обнаруженных в БАЖ с помощью кПЦР и тяжестью патологических изменений в легких. Забор у свиней различных возрастных групп образцов крови, проводимый на предмет обнаружения в сыворотке антител, дает возможность охватить обследованием большое количество свиней и точно определить природу болезни. У кросс-секционного метода забора образцов (у различных возрастных групп за раз) есть то преимущество, что результат может быть получен быстро. Преимуществом же метода последовательного выборочного контроля является то, что с течением времени обследуются/исследуются одни и те же животные (группы животных) и собирается дополнительная информация о последовательности инфекций в таких группах. Серологию на M. Hyopneumoniae следует интерпретировать на уровне групп. Доступными производителям методами ИФА корреляцию между уровнем антител в сыворотке и степенью защиты обнаружить не удалось. В полевых условиях, сероконверсия может занять срок от 3 до 8 недель и даже больше.
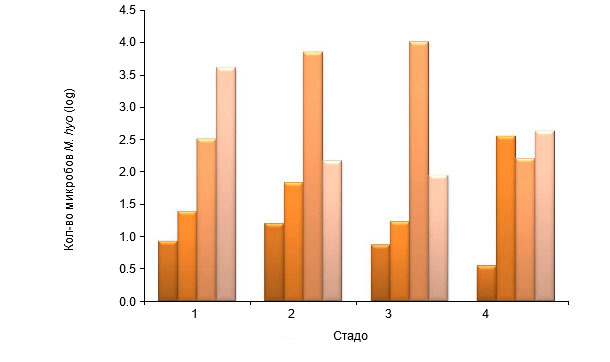
Рис.1. Число микроорганизмов M. hyopneumoniae (ср. лог. к-во микроорганизмов на мл), определенное методом кПЦР в бронхоальвеолярной жидкости (БАЖ) свиней на 4-х различных фермах, по достижении ими возраста в 6-, 10- и 14- недель и при отправке на убой (Vranckx и др., 2012)


