Обнаружение антигенов вируса РРСС
Доказательный диагноз РРСС у больных свиней может быть поставлен на основании выявления характерных микропатологий, наблюдаемых на фоне присутствия вирусного антигена в пораженных тканях. Обнаружение антигена/ов вируса РРСС в тканях может быть выполнено с помощью таких тестов, как реакция флюоресцирующих антител (ФА) и иммуногистохимическая (ИГХ) реакция (Рис.1). Эти тесты позволяют выявить как моно- , так и поликлональные антитела, специфичные для РРССВ. Прямое ФА-исследование замороженных тканей является недорогим и быстрым, однако – не всегда точным. В частности, его результаты в значительной степени зависят от состояния тканей (автолиз). ИГХ, напротив, применяется для обнаружение вирусного антигена в тканях, закрепленных в формалине. ИГХ является более чувствительным, чем прямой ФА-тест, однако, занимает больше времени и обходится дороже.

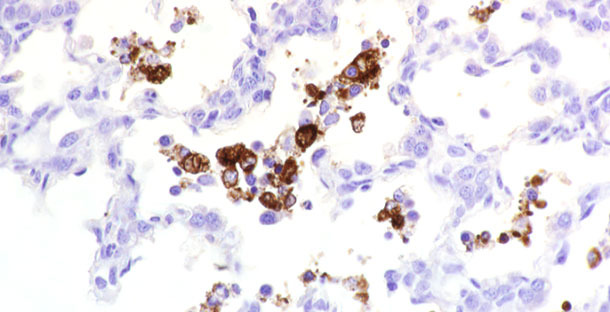
Рис.1. Антиген РРССВ в ткани.
На прямое ФА-исследование должны отправляться свежие или замороженные ткани. Если ткани отправляются на ИГХ-исследование, они должны быть зафиксированы в 10%-ном нейтральном буферном формалине. В то же время, длительная фиксация тканей в формалине оказывает на эффективность выделения антигенов с помощью ИГХ негативное влияние. Если в выполнении таких исследований ожидается задержка, рекомендуется после выполнения фиксации в формалине помещать ткани в спирт. Тканями, наиболее подходящими для этих исследований, являются сердце, почка, легкое, лимфоузел, селезенка, тимус и миндалевидная железа. Кроме того, антигены РРССВ могут также быть обнаружены в надпочечной железе, стенках кишечника, печени и, иногда, в головном мозге. При выполнении ФА и ИГХ исследований могут использоваться моноклональные антитела, специфичные для антигенов, присущих распространенным в ЕС и США изолятам. Для оценки антигенных различий разных штаммов могут также использоваться моноклональные антитела против менее характерных эпитопов. Если диагностика РРСС производится с помощью ФА или ИГХ, то, в силу высокой специфичности моноклональных антител и значительной антигенной вариабельности вируса РРСС, лучше всего, если при исследованиях будет использован больше, чем один вид антител, что поможет избежать ошибок в постановке диагноза.
Обнаружение геномного материала вируса РРСС
Для обнаружения в исследуемом материале РНК вируса РРСС были разработаны ПЦР (полимеразная цепная реакция)-тесты. Поскольку, вирусная РНК может быть обнаружена без изолирования вируса в клеточной культуре, результат с помощью ПЦР получается гораздо быстрее, чем при изоляции вируса. В общем случае, считается, что ПЦР-исследованиям присуща высокая чувствительность и специфичность.
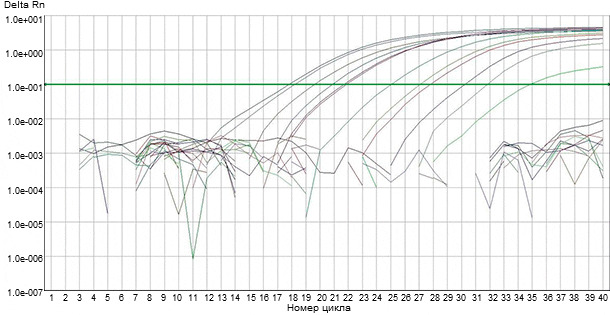
Рис.2. Обнаружение геномного материала вируса РРСС с помощью автоматизированных флуорогенных ПЦР-тестов.
Для обнаружения в клинических образцах генетических материалов вируса РРСС были разработаны несколько видов ПЦР-анализа, основанных на использовании специфических, в зависимости от последовательностей различных геномных фрагментов, праймеров. При проведении любого ПЦР-анализа на РРССВ из клинического образца должна быть выделена вирусная РНК, которая затем должна конвертироваться в комплементарную ДНК (кДНК) с использованием энзима обратной транскриптазы (ОТ). Затем, в процессе ПЦР кДНК экспоненциально амплифицируется под воздействием термостабильного (TAQ) полимеразного энзима и вирус-специфичных праймеров. Для того, чтобы анализ отличался высокими чувствительностью и специфичностью, необходимы точный подбор праймеров и последующая эспоненциальная амплификация. Не так давно были разработаны автоматизированные флуорогенные ПЦР-тесты (RT-qPCR), позволяющие обнаружить в клинических образцах геномный материал вируса РРСС (Рис.2). В них используется одношаговая амплификация в одной пробирке, при этом детекция ПЦР-продукта флуоресцентным зондом идет по мере его накопления (отсюда, «ПЦР в реальном времени»). Есть надежда, что надежность и стабильность обнаружения вируса РРСС при проведении RT-PCR с помощью флуорогенных ПЦР-тестов могут быть повышены. (Рис.3)..
Рис.3. Флуорогенные ПЦР для детекции РРССВ.
ПЦР-тесты для обнаружения РНК вируса РРСС применялись при исследовании целого ряда клинических препаратов, а также ротовых жидкостей и проб окружающей среды. РНК особенно применима для выявления вирусной РНК в пробах такого материала, как семя или экскременты, которые либо слишком цитотоксичны для высева, либо не могут быть оценены другими методами. Кроме того, они оказались весьма полезными при обнаружении РНК вируса РРСС в тканях плода и торакальных жидкостях, т.е., там, где РРССВ легко может инактивироваться в процессе автолиза. Применение ПЦР-тестов стало более обыденным делом как при диагностике РРСС, так и в качестве средства, облегчающего мониторинг поголовья (напр., скрининг ремонтного поголовья, выявление носителей и т.п.) и способствующего биобезопасности (напр., исследование проб окружающей среды, проверка транспорта, семени и т.п.).
По сравнению с другими диагностическими методами, ПЦР является более дорогим. При этом следует помнить, что полученный с его помощью положительный результат подтверждает присутствие вирусной РНК, но не обязательно свидетельствует о присутствии контагиозного вируса РРСС. Кроме того, процедура ПЦР-исследований в разных лабораториях может различаться, в зависимости от состояния образцов, методики работы с ними, технологии экстракции, используемых праймеров, условий термоциклирования, а также опыта персонала. Поэтому важно, чтобы лаборатории, выполняющие ПЦР-исследования, предоставляли подтверждения валидации своих анализов, в качестве которых могут использоваться оценки чувствительности, специфичности, сравнения с «золотыми стандартами», результаты проверки квалификации, а также экспериментальные и полевые исследования действенности методик




