Гистологическое исследование фрагментов кишечных тканей, о котором упоминалось в предыдущей статье, может помочь в определении возможного агента, вовлеченного в процесс, и, в некоторых случаях – выявить присутствие инфекционного агента. Например, атрофия кишечных ворсинок может быть вызвана коксидиями (I. suis), ротавирусом, вирусом ТГЭ, вирусом ЭДС, дельтакоронавирусом или даже C. perfringens тип A. Если образцы материала взяты у поросят возраста старше, чем 5-6 дней, в цитоплазме энтероцитов в кончиках кишечных ворсинок могут быть обнаружены различные формы I. Suis. Если не найдены кокцидии, для определения наличия в энтероцитах вирусного антигена может быть выполнен иммуногистохимический анализ на ротавирус или коронавирус. Почти всегда, когда присутствует энтеротоксигенная кишечная палочка (ETEC), гистологическое исследование обнаруживает мириады коккобациллярных микроорганизмов, укрепившихся на поверхности энтероцитов, у основания латеральной части кишечных ворсинок. C. perfringens тип C вызывают трансмуральные фибрионекротические и геморрагические сегментальные поражения в тонком кишечнике. Также, зачастую можно наблюдать отечность мезоколона (брыжейки ободочной кишки). Уменьшение количества бокаловидных клеток и интенсивная инфильтрация нейтрофилов в слизистую оболочку ободочной кишки, иногда приводящая к прорыву эпителиального слоя, напоминающему извержение вулкана – основные симптомы, наблюдаемые в случае инфекции C. difficile. C. perfringens тип A – патоген, который трудно выявляется методом гистопатологии, поскольку он может вызвать атрофию кишечных ворсинок. Однако, отсутствие такого симптома не может являться основанием для исключения вероятности присутствия этого патогена
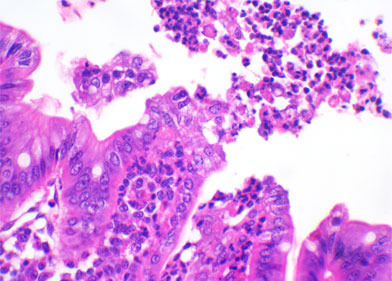
Clostridium difficile

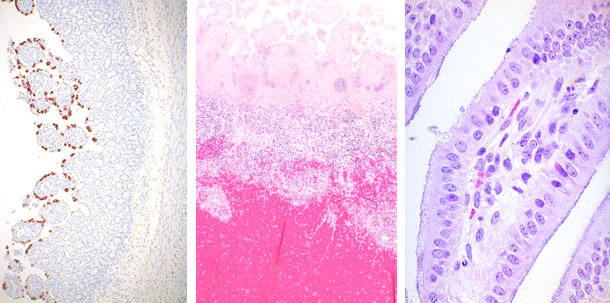
| Ротавирус | Clostridium perfringens | E. coli |
Очень важно, чтобы бактериология незафиксированных фрагментов кишечника проводилась и в аэробных, и в анаэробных условиях. Конечно, E. coli активно размножаются в среде из крови и агаров Мак-Конки, однако даже чистая культура из бета-гемолитических колоний не является диагностическим доказательством, поскольку без ее типизации невозможно продемонстрировать присутствие патогенных факторов, таких как гены фимбрии F4, F5, F41, F18…) и токсинов (LT, STa, STb, STx2e,…). Такая типизация чаще всего проводится методом многолокусной ПЦР. С точки зрения дефинитивной (доказательной) диагностики C. perfringens тип C, важное значение имеет анаэробная культивация, дополняемая молекулярной типизацией (многолокусная ПЦР), проводимой с целью выявления генов токсинов, таких как бета-токсин. Стандартная бактериология не видит различий между C. perfringens А и С-типа. В недавнем прошлом обнаружение гена бета-2-токсина считалось маркером патогенного штамма C. perfringens типа А. Однако, последние исследования, проведенные как нашей группой, так и группой ученых Университета штата Айова, показывают, что бета-2-положительные штаммы C. perfringens типа А у здоровых поросят обнаруживаются чаще, чем у страдающих диареей. Как результат, доказательная диагностика C. perfringens типа А является одним из самых непростых дел.
При рутинной диагностике трудно обеспечить изоляцию вирусов. Именно поэтому приходится использовать альтернативные методы тестирования. Достаточно нечасто для обнаружения осколков корона- и ротавирусов используются электронные микроскопы, и происходит это только в некоторых диагностических лабораториях США. Гораздо чаще для идентификации сегментированной РНК ротавирусов А, В и С применяют метод полиакриламидного гелевого электрофореза образцов каловых масс. При этом, использование метода многолокусной ПЦР приводит к значительному росту чувствительности. В Северной Америке многолокусная ПЦР, проводимая с использованием различных наборов праймеров, часто используется для диагностики коронавирусов (вирус ЭДС, вирус ТГС и дельтакоронавирус).
Fecal material from the large intestine is valuable for the detection of toxins A and B of C. difficile. Каловые массы из толстого кишечника – важный материал для обнаружения вырабатываемых C. difficile токсинов А и В. Поскольку этот агент является частью нормальной кишечной микробиоты, возможность обнаружения упомянутых токсинов средствами, входящими в коммерческие комплекты для ИФА-диагностики, представляет огромное значение. Важно помнить, что такие комплекты разрабатывались на основе человеческих экскрементов и что при применении их для исследования экскрементов поросят чувствительность гораздо ниже. Именно поэтому, с точки зрения точности метода, размер образца имеет значение. Рекомендуется проводить анализ не менее 3-6 образцов экскрементов, полученных от поросят, страдающих от диареи. Исходя из тех же самых соображений, для обнаружения ооцитов кокцидий часто проводят прямое обследование каловых масс, а т.к. надежность метода также невысока, рекомендуется для такого обследования брать экскременты 3-5 поросят 7-21-дневного возраста из гнезд, пораженных клинической диареей. Количество гнезд, из которых производился забор экскрементов, должно составлять не менее 10% от их общего числа.
В заключение, обследование новорожденных поросят на энетеропатогенные агенты всегда было делом непростым. Главное, о чем ни в коем случае не стоит забывать – подход должен быть комплексным, позволяющим взвесить все вероятности. Исходя из этого, забор образцов должен проводиться таким образом, чтобы обеспечить возможность их исследования на все возможные агенты, способные стать вызвать диарею. ПЦР – мощный инструмент, однако не следует полагаться только на него. Старые добрые методы, вроде гистопатологии, помогут более правильно интерпретировать результат и расширят ваши перспективы.


