Haemophilus parasuis (HPS) продолжает создавать проблемы свинопроизводителям, являясь причиной фибринозного полисерозита, менингита и артрита, синдрома, известного как болезнь Глессера. Она считается одной из самых распространенных бактериальных инфекций на доращивании и регулярное применение лекарственных средств для борьбы с этим заболеванием – новая головная боль свиноводов. По факту, более 50% всех системных проб, протестированных в Ветеринарно-диагностической Лаборатории Университета штата Айова (ISU VDL) на HPS методом ПЦР, оказались положительными (Рис.1).
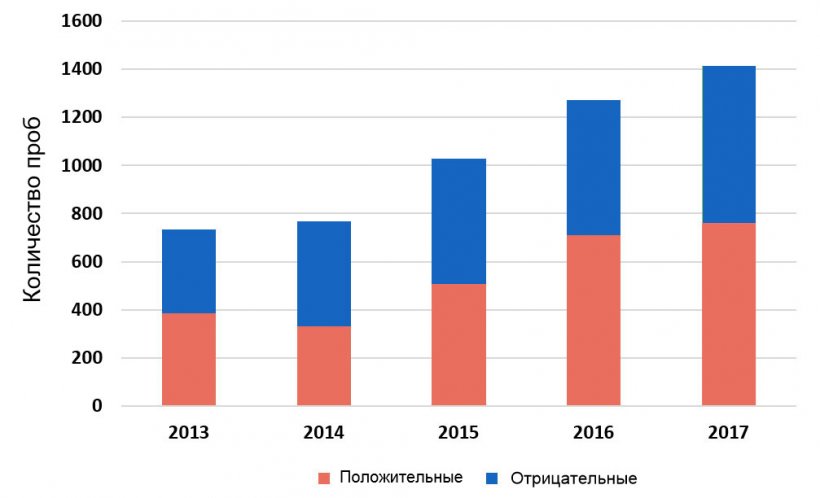
Рисунок 1. Выявление H. parasuis помощью ПЦР в системных пробах, полученных в 2013-2017 г.г. База данных ISU, 2018

Если говорить о вакцинации, инактивированные цельноклеточные вакцины показали, что они, в общем случае, обладают защитными свойствами лишь против того же самого серотипа. HPS же – патоген весьма многоликий, и с помощью реакции преципитации в агаровом геле (AGPT) и непрямой гемогглютинации (IHA) уже было иписано 15 его серотипов (Turni и Balckall, 2005). Упомянутые методы серотипирования основаны на реакциях между поверхностными антигенами, например, капсульными полисахаридами и иммунной сывороткой (антисерумом). Хотя традиционное серотипирование остается самым частоиспользуемым методом изучения характеристик HPS, значительное число изолятов являются нетипируемыми.
Дальнейшее развитие молекулярных методов привело к разработке мультиплексного ПЦР-серотипирования (Howell et al., 2015; Lacouture et al., 2017). При этой реакции используются особые праймеры, реагирующие на серотип-специфичные вариации на капсульных локусах и способные распознать 14 из 15 серотипов HPS. Способность надежно дифференцировать серотип 5 от серотипа 12 не подтвердил ни один капсульно-полисахаридный ген. В 2017 г. Джиа (Jia) с коллегами предложили новую, специфичную к серотипам HPS, схему ПЦР, предполагающую использование праймеров, дифференцирующих серотип 5 от серотипа 12. Как бы то ни было, в основе праймера для серотипа 12 лежит гипотетический ген, а стало быть, дальнейших исследований не избежать.
Сравнение серотипирующей ПЦР и IHA продемонстрировало, что оба метода показали одинаковый результат для 88% изолятов, протестированых на HPS. Наблюдаемая разница может быть объяснена сложностью метода IHA. Наиболее поразительное отличие в том, что количество нетипируемых штаммов (штаммов, которые не могут быть серотипированы применением антисерума) значительно сократилось (Howell и др., 2015; Lacouture и др., 2017). Серотипирующая ПЦР была оптимизирована и теперь она предлагается ISU VDL.
По результатам анализа направленного в ISU VDL набора из 216 штаммов HPS, выделенных из взятых у свиней проб, только три изолята (0,5%) оказались нетипируемыми серотипирующей ПЦР, а это значительно меньше, чем при использовании обычных методов (15% - 41%). Наиболее часто идентифицируемыми были серотипы: 4 (24%), 7 (26,7%), 1 (14,8%) 2 (13,4%), 5/12 (13%) и 13 (10,2%). За ними шли серотипы 14 (5,6%) и 6 (0,9%) (Рис.2). Данные серотипы также обычно выявляются на реальном производстве в США, Канаде, Европе и Китае.

Рисунок 2: Дистрибуция серотипов Haemophilus parasuis в респираторных и системных изолятах, исследованных с помощью серитипирующей ПЦР
Большая часть изолятов из этой коллекции была выделена у свиней, больных пневмонией и полисерозитом. Основным местом локализации изолятов HPS были легкие (Рис.2), за ними шли такие системные очаги, как: перикард (21%), плевра (7%), сустав (5%), мозговая оболочка (менинг) (3,7%), брюшина (1,4%) и фибрин (0,5%). Это служит веским основанием предположить, что данные изоляты являлись вирулентными, в силу своей способности сопротивляться гибели от сыворотки и фагоцитозу – два общеизвестных вирулентных механизма при HPS (Cerda-Cuellar и Aragon, 2008; Olvera и др., 2009). Из системных очагов были выделены даже серотипы 6 и 7, ранее, согласно схеме Kielstein-Rapp-Grabrielson считавшиеся невирулентными (Kielstein и Rapp-Gabrielson, 1992). HPS может выделяться из легких здоровых свиней, и обычным делом являются коинфекции. Поэтому, всегда следует учитывать присутствие у животного других заражающих его потенциально вирулентных штаммов.
Был проведен раздельный анализ ста двадцати трех изолятов HPS, полученных с шести различных свиноводческих производственных систем США, с тем, чтобы оценить частоту серотипов на этих производствах. Серотипы продемонстрировали высокую вариабельность, в частности, потому что каждая производственная система состояла из нескольких различных ферм. Тем не менее, в большинстве случаев в каждом из потоков преобладал только какой-то один серотип. Также, мы обнаружили, что серотипы 4 (23,5%, 29/123) и 7 (22,7%, 28/123) присутствовали во всех системах (Рис.3).

Рисунок 3: Дистрибуция Haemophilus parasuis в шести самостоятельных свиноводческих производственных системах
Борьба с HPS требует комплексного подхода. Первый шаг – изучить характеристики изолята, обнаруженного у заболевших свиней. Мониторинг присутствия серотипов HPS в поголовье важен для сохранения контроля над болезнью. Серотипирующая ПЦР и мультиплексная ПЦР на вирулентно-ассоциированные аутотранспортеры (VtaA PCR) могут служить полезным инструментом, особенно в таких вещах, как: селекция вирулентных серотипов для включения их в аутогенные вакцины; улучшение менеджмента потока животных путем группирования и объединения источников с одним и тем же серотипом; и недопущения попадания свиней-носителей потенциально вирулентных штаммов HPS в «чистые» поголовья.



