Респираторные заболевания у свиней имеют множественные причины с участием различных факторов: возбудители инфекций, питание и факторы организации производства, провоцирующие развитие болезни, такие как температура, вентиляция, плотность размещения, условия содержания и т.д.
К наиболее значимым возбудителям инфекций, нашедшим отражение в комплексе респираторных заболеваний у свиней (КРЗС), относятся:

- Бактерии: микоплазма гиопневмонии, актинобациллярная плевропневмония, гемофилюс парасуис, пастерелла мультоцида, свиной стрептококк и микоплазма гиоргинис.
- Вирусы: вирус РРСС, вирус гриппа, ЦВС-2, респираторный коронавирус.
- Паразиты: нематоды рода Metastrongylus.
В лабораторном анализе содержится подробная информация о наличии возбудителей инфекций, вовлеченных в патологический процесс, что позволяет принять более взвешенное решение относительно реализации эффективных мер. В зависимости от наличия и цели анализа (диагностика клинических случаев или мониторинг фермы), можно проанализировать различные типы проб (Таблица 1.)
ТАБЛИЦА 1: Тип дыхательных проб, преимущества и недостатки.
| ТИП ПРОБЫ | ПРЕИМУЩЕСТВА | НЕДОСТАТКИ |
| Легкие |
|
|
| Бронхоальвеолярные лаважи или соскоб с бронхов |
|
|
| Жидкости ротовой полости |
|
|
| Мазки из носа |
|
|
Бронхоальвеолярные лаважи и соскоб с бронхов (рисунок 1) очень результативны в случае респираторных проблем у животных, демонстрирующих респираторные признаки, такие как кашель или одышка, но без смертельных случаев. Это позволяет отбирать пробы у значительного количества животных, группируя их по возрасту, загону или стадии производства. Это обеспечивает точной информацией о микроорганизмах, присутствующих в легких.
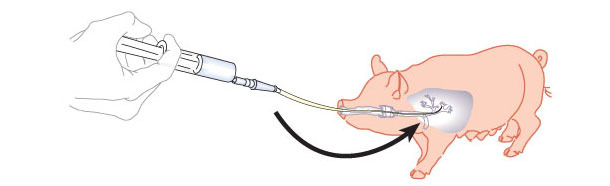
Рисунок 1. Схематический рисунок, показывающий бронхоальвеолярный лаваж и соскоб с бронхов
Эта методика является простой и быстрой при условии, что лицо, собирающее пробы, знакомо с ней. Следующий видеоролик демонстрирует технику. Доступ может быть оральным или назальным и, в зависимости от типа доступа и возраста животного, должны быть в наличии различные типы катетеров.
Процедура в отношении соскоба с бронхов такая же, как и для лаважа, за исключением введения солевого раствора. Как только катетер достиг бронхов, то катетер удаляют и его наружную часть подсоединяют к шприцу, содержащему 1-2 мл стерильного солевого раствора.
Чтобы оценить эффективность каждого метода отбора проб для выявления вышеупомянутых возбудителей инфекций, было проведено исследование, сравнивающее результаты, полученные при использовании бронхоальвеолярных лаважей и соскобов с бронхов, используя метод ПЦР в режиме реального времени (КПЦР).
Исследование проводилось на группе из 68 животных, взятых из трех разных ферм. К этой группе относились животные на основных стадиях производства: подсосные поросята (количество = 1), поросята-отъемыши (количество = 11), свиноматки (количество = 17), собственные ремонтные животные (количество = 12) и свиньи на откорме от 30 до 100 кг (количество = 27).
У каждого животного брали бронхоальвеолярные лаважи и соскобы с бронхов. Впоследствии для получения нуклеиновых кислот (ДНК и РНК) при каждой пробе использовали автоматическую экстракционную систему, а наборы для проведения КПЦР использовали для молекулярного определения следующих показателей: вирус РРСС, ЦВС-2, вирус гриппа A, микоплазма гиопневмонии, микоплазма гиоргинис, актинобациллярная плевропневмония, гемофилюс парасуис и свиной стрептококк. Все пробы со значением Cq <38 считались положительными.
Все возбудители инфекций были обнаружены в обоих типах проб; результаты показаны в таблице 2.
Таблица 2: Результаты КПЦР для показателей, проанализированных в обоих типах проб, выраженные в процентах от положительных образцов.
| ПОКАЗАТЕЛЬ | ЛАВАЖ | СОСКОБ |
| Вирус РРСС | 31.1 | 30.7 |
| ЦВС-2 | 3.9 | 4.0 |
| Вирус гриппа A | 2.6 | 5.3 |
| Микоплазма гиопневмонии | 26.0 | 29.6 |
| Микоплазма гиоргинис | 62.3 | 77.3 |
| Актинобациллярная плевропневмония | 16.9 | 22.7 |
| Гемофилюс парасуис | 44.2 | 46.7 |
| Свиной стрептококк | 50.0 | 87.84 |
Учитывая небольшой размер выборки, результаты были статистически сопоставлены с использованием точного критерия Фишера. Существенные различия были обнаружены только для определения микоплазмы гиоргинис и свиного стрептококка. Обнаружение в отношении этих показателей было выше в пробе, полученной путем соскоба с бронхов. Никаких существенных различий в уровне обнаружения для других исследованных показателей не наблюдалось.
Многие ветеринары на местах находят соскоб с бронхов менее инвазивным и, прежде всего, более простым методом отбора проб, чем бронхоальвеолярный лаваж. В дополнение к этим преимуществам у соскоба с бронхов необходимо учитывать эквивалентную или даже лучшую способность обнаружения основных патогенов, представляющих интерес в КРЗС. Последующие исследования должны проводиться с большими объемами выборки, чтобы детально проанализировать другие переменные, такие как возраст животных и количественные результаты у соответствующих возбудителей. Тем не менее, можно сделать вывод, что соскоб является эффективным методом отбора проб, и он может быть провозглашен в качестве действенной альтернативы в отношении бронхоальвеолярных лаважей.



