Методы выявления антител к вирусу РРСС
Непрямая реакция флюоресцирующих антител (НРФА), реакция нейтрализации (РН) вируса иммунной сывороткой, иммунопероксидазный монослойный анализ (ИПМА) и иммуноферментный анализ (ИФА) – все были использованы для обнаружения антител, специфичных для вируса РРСС. НРФА, РН и ИФА доступны в большинстве североамериканских ветеринарных диагностических лабораторий, в то время как ИПМА широко используется в Европе. Все тесты могут рассматриваться как специфичные с различной степенью сенситивности. Обычно НРФА, ИПМА и ИФА предназначены для обнаружения общего антитела изотипа IgG, специфичного для РРСС, а тест на РН вируса иммунной сывороткой используется для обнаружения функционального антитела, связанного с иммунитетом или иммунной защитой. НРФА и ИФА были адаптированы для обнаружения других изотипов, таких как IgM или IgA (Рисунок 1). Вирус РРСС – специфичные антитела IgG, которые могут быть обнаружены при помощи НРФА, ИФА или ИПМА, производятся у инфицированных свиней в период от 7 до 14 дней после заражения; хотя антитела РН могут быть обнаружены только в период от 1 до 2 месяцев после заражения (Рисунок 2). Вообще антитела к вирусу РРСС при активной инфекции могут быть достоверно обнаружены в период от 3 до 4 месяцев после заражения и могут сохраняться в течение от 6 месяцев до 1 года после вспышки заболевания.

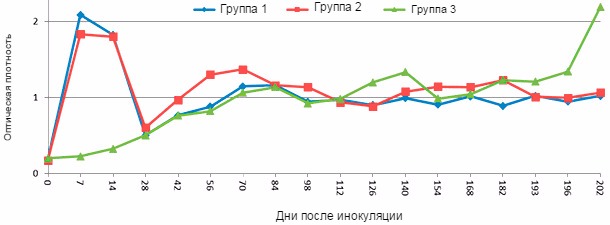
Рисунок 1. Ответная реакция в виде антител IgM у молодых свиней после экспериментального заражения вирусом РРСС, как было определено с помощью иммуноферментного анализа с модификациями при использовании диагностических наборов фирмы IDEXX. Группы 1 и 2 были интраназально инокулированы вирусом РРСС типа 2 в день 0. Группа 1 была повторно инокулирована на 196 дней после инокуляции, тогда как группа 2 не была. Группу 3 не инокулировали вирусом РРСС до 196 дня. Антитела IgM, специфичные для вируса РРСС, поддаются обнаружению на 7 день после инокуляции, но возможность обнаружения резко снижается через 14 дней после инокуляции (Низами С. и Юн К.Дж., неопубликованные данные).
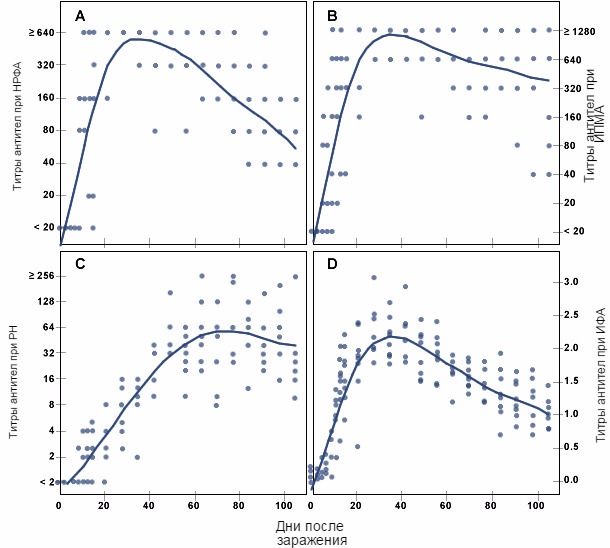
Рисунок 2. Ответная реакция в виде специфичных антител на вирус РРСС у свиней в течение продолжительного периода времени после экспериментального заражения, как было определено в исследованиях при использовании непрямой реакция флюоресцирующих антител (А), иммунопероксидазного монослойного анализа (В), реакции нейтрализации вируса иммунной сывороткой (С) и иммуноферментного анализа (D) (Из публикации Юн К.Дж. и др.: Характеристика гуморального иммунного ответа на заражение вирусом РРСС. Journal of Veterinary Diagnostic Investigation (Журнал ветеринарных диагностических исследований), 7: 305-312, 1995)
Тесты на основе НРФА и ИПМА задействуют инфицированные вирусом клетки в качестве антигена (Рисунок 3). Преимущество тестов на основе НРФА и ИПМА по сравнению с ИФА заключается в том, что величина титра антител может быть определена. Тем не менее, конечное состояние титров антител НРФА изменяется в зависимости от специалистов и лабораторий, так как интерпретация субъективна. Кроме того, результаты тестов или конечное состояние титров будет варьироваться в зависимости от степени антигенного отличия штамма вируса РРСС, используемого в исследовании, от того изолята, которым была заражена свинья.
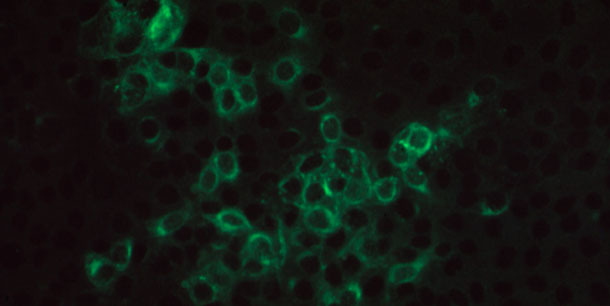
Рисунок 3. Микрофотография положительной иммунофлуоресценции на инфицированный вирусом РРСС монослой клеток MARC145, инкубированный свиной сывороткой, содержащей специфичные антитела IgG вируса РРСС, и помеченный козьими анти - свиными антителами IgG, сопряжёнными с флуоресцентным красителем
Предполагается, что ИФА является более сенситивным, чем НРФА. Было описано несколько форматов ИФА: непрямой ИФА, использующий систему положительных реакций образцов, непрямой ИФА, использующий конкретные дежурные показатели, а также блокирующий вариант ИФА. В настоящее время существует несколько коммерчески доступных наборов ИФА для обнаружения в сыворотке крови антител, специфичных к вирусу РРСС (Рисунок 4). Неизменность стандартов в изготовлении комплекта и высокая степень автоматизации при проведении теста в диагностической лаборатории даёт меньшее число вариаций в результатах коммерческого ИФА по сравнению с другими видами исследований. Другие преимущества коммерческого ИФА заключаются в следующем: а) обнаружение антител против обоих типов РРСС; б) небольшой интервал времени между сбором анализов и получением результатов; в) использование практики лицензирования. В последнее время платформа ИФА также была адаптирована для тестирования образцов ротовой жидкости на обнаружение антител вируса РРСС в рамках мониторинга стада.
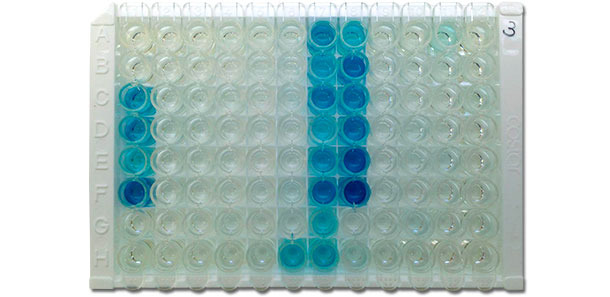

Рисунок 4. Фотография иммунологического планшета для ИФА фирмы IDEXX, показывающий положительные результаты (синий цвет) и отрицательные результаты (без цвета). Интенсивность цвета коррелирует с уровнем антител в сыворотке, то есть чем темнее цвет, тем выше титр антител. (Фото публикуется с разрешения д-ра Дэвида Баума, Университет штата Айова, ветеринарная диагностическая лаборатория)
Тест РН также считается специфическим тестом, но предыдущие исследования показали, что этот тест менее сенситивный, чем НРФА и ИФА. Низкая сенситивность теста наблюдается, прежде всего, из-за того, что нейтрализующие антитела против вируса РРСС развиваются поздно и медленно. Тест РН лучше всего рассматривать в качестве исследовательского инструмента, а не в качестве рутинного диагностического теста из-за его трудоёмкости. Как и при использовании НРФА и ИПМА, результаты теста сильно зависят от степени антигенного родства между изолятом, задействованным в тесте, и изолятом, которым заражают свиней.
Интерпретация серологических результатов в диагностике РРСС
Серологический анализ может быть полезным для подтверждения наличия (т.е. серопозитивность) и статуса (например, высокий уровень антител в недавней инфекции) заражения вирусом РРСС в стаде. Серологическая информация от одного образца не является достаточной для диагностики клинического РРСС у отдельного животного, потому что вирусная инфекция РРСС широко распространена в стадах свиней. Возможное присутствие материнских антител следует учитывать при интерпретации результатов серологических исследований молодых свиней. Важно также иметь в виду, что существующие серологические тесты, используемые в диагностике, не могут как положено дифференцировать антитела вакцинного происхождения от антител изолятов, полученных в полевых условиях. Кроме того, случай ложного сероположительного результата на вирус РРСС был зарегистрирован даже при использовании коммерческого набора ИФА. Отрицательные результаты серологического анализа образцов на РРСС в один и тот же момент времени также имеют несколько возможных объяснений: а) Свиньи не были заражены вирусом; б) Свиньи недавно были инфицированы вирусом, и у них ещё не видоизменилась серологическая специфичность; в) Свиньи были инфицированы вирусом, но стали серонегативными; и г) Результат был отрицательным из-за низкой сенситивности теста или лабораторных ошибок. Таким образом, при использовании одинаковых образцов, серологический анализ РРСС должен проводиться в сочетании с адекватными методами, использующими популяционные группы, чтобы определиться в том, что стадо подверглось воздействию вируса РРСС, а не в том, что инфицированы отдельные животные.
Как правило, для определения статуса заражения вирусом РРСС рекомендуется проверять молодых свиней, а не племенной скот. В стадах полного цикла от опороса до убоя, расположенных в одном месте, серопревалентность вирусной инфекции РРСС обычно считается самой высокой в откормочнике. Сывороток от 10 свиней на откорме часто достаточно, чтобы определить, подверглось ли стадо воздействию вируса РРСС. Для фермерских хозяйств с обособленными производственными стадиями каждая стадия представляет собой отдельное поголовье, которое должно быть обследовано, а ряд образцов крови на различных этапах производства полезно использовать для определения возраста, для которого заражение вирусом РРСС является наиболее распространенным.
Серодиагностика заражения вирусом РРСС как причины репродуктивной недостаточности или респираторного заболевания может быть достигнута отображением сероконверсии при помощи парных образцов сыворотки или изменения титра антител (т.е. при росте титра антител) в парных сыворотках. Тем не менее, свиноматки могут подвергаться воздействию вируса за 2 или большее количество недель до возникновения клинических признаков, когда рост титров антител не может наблюдаться. Наличие антител к вирусу РРСС в плодных жидкостях или в крови, собранных из мертворожденных и слабых поросят перед приёмом молозива, также свидетельствует о заражении вирусом РРСС. Тем не менее, окончательная диагностическая оценка РРСС в отношении клинического проявления болезни требует интерпретации серологической информации в сочетании с результатами других вирусных анализов.



