Adsorción: Cómo actúan los secuestrantes – el ejemplo de la Bentonita
Adsorptie (of biosorptie) is een fascinerend proces waarbij mycotoxinen een interactie aangaan met bindmiddelen op hun oppervlak of in hun lagen. Deze interactie vindt plaats via niet-covalente bindingen, zoals waterstofbruggen, Van der Waals-krachten, ionbindingen en hydrofobe interacties.
Wat zijn niet-covalente bindingen?
Niet-covalente bindingen zijn een type chemische interactie die plaatsvindt tussen atomen of moleculen zonder dat er elektronen worden gedeeld of overgedragen. Er zijn verschillende soorten:
- Ionische bindingen : Ionische bindingen ontstaan tussen ionen met tegengestelde ladingen. Het ene atoom doneert elektronen (kation), terwijl het andere atoom elektronen opneemt (anion).
- Waterstofbruggen : ontstaan wanneer een waterstofatoom covalente bindingen aangaat tussen twee elektronegatieve atomen (zoals zuurstof of stikstof).
- Van der Waalskrachten : Deze ontstaan door tijdelijke schommelingen in de verdeling van elektronen binnen moleculen. Deze krachten kunnen worden onderverdeeld in drie typen: London-dispersiekrachten, dipool-dipoolinteracties en geïnduceerde dipool-dipoolinteracties. Tussen alle moleculen bestaan Londondispersiekrachten.
- Hydrofobe interacties : Deze vinden plaats tussen niet-polaire moleculen in de aanwezigheid van water. Apolaire moleculen zijn hydrofoob (waterafstotend) en hebben de neiging om samen te klonteren om contact met watermoleculen tot een minimum te beperken.
Figuur 1: Van der Waals-krachten

Figuur 2: Hydrofobe interacties

De meeste mycotoxinen zijn polair, zoals aflatoxine, DON, T2 – HT2, ochratoxine A, fumonisine, terwijl ZEA apolair is.
Hoe bindt bentoniet zich aan polaire mycotoxinen zoals aflatoxine?
Bentoniet bestaat uit een gelaagde structuur die bestaat uit lagen negatief geladen silicaatmineralen. Deze negatief geladen oppervlakken kunnen positief geladen ionen of moleculen aantrekken en binden via ionische interacties. (Figuur 3)
Figuur 3: Werkingsmechanisme van bentoniet bij het binden aan polaire mycotoxinen (AFLA)
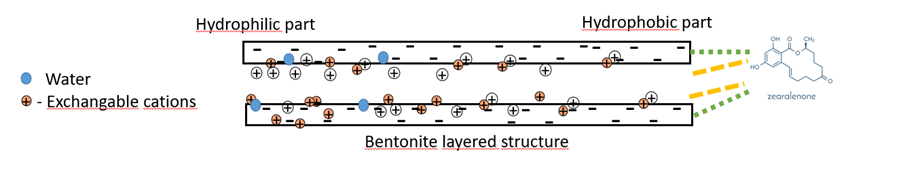
Hoe bindt bentoniet zich aan apolaire mycotoxinen zoals ZEA?
Bij apolaire mycotoxinen, die geen lading hebben, vindt de binding voornamelijk plaats op basis van hydrofobe interacties en Van der Waals-krachten.
De hydrofobe delen van mycotoxinen interacteren met de hydrofobe oppervlakken van bentoniet. Deze hydrofobe interactie zorgt ervoor dat niet-polaire mycotoxinen zich aan het oppervlak van de bentonietdeeltjes kunnen hechten.
Van der Waalskrachten stabiliseren de binding nog verder door de aantrekkelijke interacties tussen mycotoxinen en kleioppervlakken te versterken.
Figuur 4: Werkingswijze van bentoniet met apolaire mycotoxinen (ZEA)
Samenvattend is adsorptie (of biosorptie) een cruciaal proces waarbij mycotoxinen interacteren met bindmiddelen via niet-covalente bindingen, waaronder waterstofbruggen, Van der Waals-krachten, ionische bindingen en hydrofobe interacties. Als we deze niet-covalente bindingen begrijpen, begrijpen we beter hoe stoffen als bentoniet effectief zowel polaire als apolaire mycotoxinen kunnen binden.
Bij polaire mycotoxinen, zoals aflatoxine, trekken de negatief geladen oppervlakken van bentoniet deze toxinen aan en binden ze deze door middel van ionische interacties. Daarentegen worden apolaire mycotoxinen zoals ZEA voornamelijk opgevangen door hydrofobe interacties en Van der Waals-krachten, waardoor een stabiele en effectieve binding wordt gegarandeerd.
Deze kennis is essentieel voor het ontwikkelen van betere strategieën om de schadelijke effecten van mycotoxinen in verschillende omgevingen te beperken en zo bij te dragen aan veiligere en gezondere resultaten.
Контакты:
Свяжитесь с нами, используя данную форму.

